问题
计算题
(5分)
(1)0.5 mol H2O的质量为________克,其中共含有________个原子。
(2)质量相同的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是___ __(填分子式,下同),在相同温度和相同压强条件下,体积最大的是___ __。
(3)配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O________g。
答案
(5分)(1)9g;9.03×1023。(2)CO2;NH3。(3) 2.5
题目分析:(1)水的摩尔质量是18g/mol,所以0.5 mol H2O的质量为0.5mol×18g/mol=9g;根据水的化学式可知,还有1.5mol原子,其个数是1.5mol×6.02×1023/mol=9.03×1023;
(2)根据阿伏加德罗定律可知,气体的物质的量越多,分子数越多。根据n=m/M可知,在质量相同的条件下,气体的摩尔质量越小,气体的物质的量就越大,所以含有分子数目最少的是CO2;氨气的摩尔质量最小,所以体积最大。
(3)50 mL 0.2 mol/L CuSO4溶液中溶质的物质的量是0.05L×0.2mol/L=0.01mol,因此需要CuSO4·5H2O的质量是250g/mol×0.01mol=2.5g。
点评:在进行物质的量的有关计算时,应该利用好以下关系式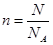 、n=m/M、
、n=m/M、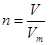 、
、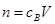 。
。

