某化学学习小组的同学欲探究测定草酸晶体(H2C2O4•xH2O)中x的值.通过查阅资料该小组同学得知:草酸易溶于水,其水溶液可以与酸性KMnO4溶液发生反应2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.该组同学利用该反应原理设计了滴定的方法测定x值.
①称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液.
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,实验记录有关数据如下:
| 滴定次数 | 待测草酸溶液体积(mL) | 0.1000mol/LKMnO4标准溶液体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 10.02 |
| 第二次 | 25.00 | 0.22 | 11.32 |
| 第三次 | 25.00 | 1.56 | 11.54 |
(1)滴定时,将KMnO4标准液装在右图中的______(填“甲”或“乙”)滴定管中.
(2)本实验滴定达到终点的标志可以是______.
(3)通过上述数据,计算出x=______.
(4)①若滴定终点时俯视滴定管刻度,则由此测得的x值会______(填“偏大”、“偏小”或“不变”,下同).
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会______.
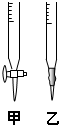
(1)因为KMnO4具有强氧化性,会腐蚀橡胶管,故应用酸式滴定管盛装,故答案为:甲;
(2)因KMnO4溶液自身的颜色作为指示剂判断滴定终点时,再滴加KnO4溶液时,溶液将由无色变为紫色,
故答案为:当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点;
(3)(3)2MnO4-+5H2C2O4 +6H+═2Mn2++10CO2↑+8H2O
2 5
0.1000mol/L×0.01L 0.0025mol
25.00mL待测液中含有0.0025molH2C2O4,100.00mL待测液中含有0.01molH2C2O4,0.01molH2C2O4的质量为0.01mol×90g/mol=0.9g,所以1.260g纯草酸晶体中水的物质的量为1.260g-0.9g=0.36g,其物质的量为0.02mol,则x=2,
若滴定终点时俯视滴定管读数,则所得消耗酸性KMnO4溶液的体积偏小,由此所得n(H2C2O4)偏小,则n(H2O)偏大,x偏大,
同理,若KMnO4溶液变质,则消耗其体积偏大,所得x值偏小,
故答案为:2;偏大;偏小.
