问题
问答题
BrCl沸点为10℃,遇水剧烈水解,有强烈的氧化性,是工业上重要的水处理杀菌剂.Br2沸点为58.8℃.某实验小组在实验室合成BrCl,其装置如图所示(夹持仪器略去):
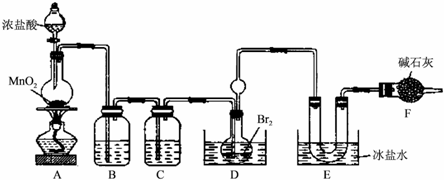
回答下列问题:
(1)装置C中的试剂为______.
(2)装置A中发生反应的离子方程式为______.
(3)装置D中球形容器及长导管的作用是______,装置D用水浴加热并控制温度40-42℃,温度不宜过高的原因是______.
(4)提纯E中得到的粗BrCl的实验操作方法是______.
答案
(1)BrCl沸点为10℃,遇水剧烈水解,有强烈的氧化性,不能含有杂质气体,分析装置图可知,A装置是反应生成氯气的发生装置,生成的氯气中含有水蒸气和氯化氢,通过装置B中饱和食盐水吸收氯化氢,利用装置C中的浓硫酸吸收水蒸气,
故答案为:浓硫酸;
(2)装置A中是制备氯气的反应,利用二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,△ .
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;△ .
(3)装置D中球形容器及长导管的作用是冷凝回流;装置D用水浴加热并控制温度40-42℃,Br2沸点为58.8℃,目的是避免溴挥发,
故答案为:冷凝回流溴,温度过高会导致大量溴挥发;
(4)BrCl沸点为10℃,利用蒸馏的方法得到粗BrCl,故答案为:蒸馏.
