中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸溶液50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从如图实验装置看,其中尚缺少的一种玻璃用品是______,除此之外,装置中的一个明显错误是______.
(2)若改用60mL0.25mol•L-1H2SO4和50mL0.55mol•L-1NaOH溶液进行反应与上述实验相比,所放出的热量______(填“相等”“不相等”),若实验操作均正确,则所求中和热______填“相等”“不相等”).
(3)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | ______ |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
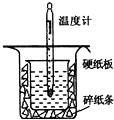
(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;为了减少热量的损失,大烧杯杯口与小烧杯杯口相平;
故答案为:环形玻璃搅拌器;大烧杯杯口与小烧杯杯口没有相平;
(2)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25mol•L-1H2SO4溶液跟50mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;
故答案为:不相等;相等;
(3)①4次温度差分别为:3.4℃,6.1℃,3.3℃,3.5℃,第2组数据明显有误,所以删掉,
温度差平均值为
=3.4℃;3.4℃+3.3℃+3.5℃, 3
故答案为:3.4;
②0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸溶液50mL进行中和反应生成水的物质的量为0.05L×0.50mol=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值△T为3.4℃来计算,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.421kJ,所以实验测得的中和热△H=-
=-56.8 kJ/mol,1.421kJ 0.025mol
故答案为:-56.8 kJ/mol.
