某类硝酸盐受热分解的产物为不含氮元素的固体物质和NO2、O2气体:
(1)某种硝酸盐受热分解后,若产生NO2和O2的物质的量之比为6︰1,则金属元素的价态在反应过程中_______(填“升高”、“降低”、“不变”)
(2) 现取mg Cu(NO3)2无水晶体,强热使其分解,得到NO2、O2和ng固体。将气体用水充分吸收后,结果还有气体剩余,同时得到100mL溶液。则:残留固体成分可能是_____________ _______________(用化学式表示);所得溶液的物质的量浓度是__________________(用只含m的代数式表示);
(3)(2)中m = 3.76,n = 1.52。试通过计算确定残留固体的成分及其质量
(1)升高 (2)CuO、Cu2O 或Cu2O;10m/92 mol/L (3)CuO 0.8g Cu2O 0.72g
题目分析:(1)产物NO2和O2的物质的量之比为6︰1可以确定升高的化合价为4,降低的化合价为6,根据得失电子数相等,则金属元素的化合价升高。
(2)因为生成的气体用水充分吸收后,结果还有气体剩余,说明生成的NO2和O2的比值不是4:1,则金属的化合价一定降低,且NO2和O2的比值小于4:1,所以剩余的成分可能为Cu2O或CuO和Cu2O的混合物。根据N守恒,求得所得溶液的物质的量浓度为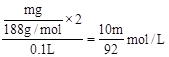 。
。
(3)n(Cu)=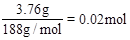 ,残留固体的质量为1.52g可知残留的固体为CuO和Cu2O。设CuO xmol,Cu2O ymol,则
,残留固体的质量为1.52g可知残留的固体为CuO和Cu2O。设CuO xmol,Cu2O ymol,则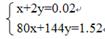 ,解得x=0.01mol,y=0.005mol,CuO为0.8g,Cu2O为0.72g。
,解得x=0.01mol,y=0.005mol,CuO为0.8g,Cu2O为0.72g。
点评:本题主要用守恒法进行计算,可以简化计算难度。
