问题
计算题
现有一种铜和氧化亚铁的混合物样品。为测定该样品中氧化亚铁的含量,某学生取20.0g此样品置于烧杯中,分四次加入密度为1.22g/cm3的硫酸并作相关记录。有关数据记录如下表:
| 加硫酸的序号 | 加硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 16.0 |
| 2 | 20.0 | 12.0 |
| 3 | 20.0 | 8.0 |
| 4 | 20.0 | 8.0 |
(1)10.0g此样品中铜的质量。
(2)样品中氧化亚铁的质量分数。
(3)所用硫酸溶液溶质的质量分数。
答案
(1)4.0g (2)60.0% (3)22.3%
题目分析:(1)根据表中数据可知,当硫酸加入60mL时,剩余固体的质量不变,因此剩余固体为铜,质量为8.0g,则10.0g此样品中铜的质量为4.0g。(2)铜的质量分数为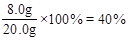 则氧化亚铁的质量分数为60%。(3)硫酸加入20.0mL,剩余固体16.0g说明反应了FeO4.0g,则反应硫酸的物质的量为
则氧化亚铁的质量分数为60%。(3)硫酸加入20.0mL,剩余固体16.0g说明反应了FeO4.0g,则反应硫酸的物质的量为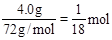 ,所以c(H2SO4)=
,所以c(H2SO4)=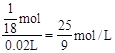 ,又知硫酸的密度为1.22g/cm3,则硫酸的质量分数
,又知硫酸的密度为1.22g/cm3,则硫酸的质量分数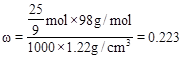 。
。
点评:本题难度适中,综合性、逻辑性较强,适合锻炼学生的逻辑思维能力。
