问题
计算题
把5.1g镁铝混合物的粉末放入200mL盐酸中恰好完全反应,得到5.6LH2(标准状况下)。试计算:
(1)该混合物中镁的质量分数。(2)盐酸的物质的量浓度。
答案
(1)47.1% (2)2.5mol/L
题目分析:(1)设混合物中镁和铝的物质的量分别是x和y,则24x+27y=5.1。根据反应的方程式Mg+2H+=Mg2++H2↑、2Al3++6H+=2Al3+3H2↑可知,x+1.5y=5.6÷22.4=0.25。解得x=y=0.1mol,所以镁的质量分数是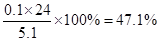 。
。
(2)根据方程式可知,消耗盐酸的物质的量是0.1mol×2+0.1mol×3=0.5mol,所以盐酸的浓度是0.5mol÷0.2L=2.5mol/L。
点评:在进行物质的量的有关计算时,关键是熟练应用几个关系式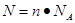 、n=m/M、
、n=m/M、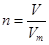 、
、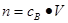 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
