现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(假定反应前后溶液的体积不变):
①向其中一份固体中加入100 mL 2.0mol•L-1的NaOH溶液,加热使其充分反应后过滤,测得溶液C(OH—)=1mol/L
②向另一份固体中加入100mL 4.0 mol•L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且C(H+)=0.1mol/L则产生的气体的体积(标准状况)为
A.2.352L
B.2.448L
C.2.688L
D.2.856L
答案:D
题目分析:第一个反应后溶液显碱性,说明溶液中元素Al都以AlO2-形式存在,Fe及其氧化物和碱不反应,则溶液里的物质就是NaAlO2、NaOH,其中OH-浓度是1mol/L,则根据钠离子守恒可知,AlO2-的物质的量就是0.1mol;由(1)可知,在第二个反应中Al3+的物质的量是0.1mol,氢离子的物质的量是0.01mol,氯离子的物质的量是0.4mol,所以亚铁离子的物质的量是(0.4-0.01-0.1×3)/2=0.045mol。根据反应式2Al+Fe2O3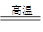 2Fe+Al2O3可知,反应后每一份中单质铁的物质的量是0.045mol,单质铝的物质的量是0.1mol-0.045mol=0.055mol,所以再和盐酸的反应中,生成的氢气物质的量是0.045mol+0.055mol×1.5=0.1275mol,所以在标准状况下的体积是0.1275mol×22.4L/mol=2.856L,答案选D。
2Fe+Al2O3可知,反应后每一份中单质铁的物质的量是0.045mol,单质铝的物质的量是0.1mol-0.045mol=0.055mol,所以再和盐酸的反应中,生成的氢气物质的量是0.045mol+0.055mol×1.5=0.1275mol,所以在标准状况下的体积是0.1275mol×22.4L/mol=2.856L,答案选D。
点评:该题属于较难的试题,既要根据电荷守恒,计算离子的浓度,还要判断铝热反应中反应物的过量问题,对学生的思维能力和审题能力都提出了较高的要求。一般思路是:在对物质转化过程的分析与判断的基础上,借助“守恒原理”,快刀斩乱麻,简化解题。除守恒法外,还有常用极值法、差量法等。
