海水的综合利用可以制备金属镁,其流程如下图所示:
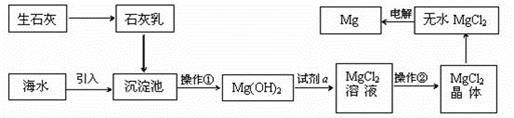
提示:①MgCl2晶体的化学式为MgCl2·6H2O;
②MgO的熔点为2852oC,无水MgCl2的熔点为714oC。
(1)操作②的名称是________、________、过滤。
(2)试剂a的名称是_______________________。
(3)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤_____________________________
_________________________________________________________________________。
(4)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质;而不采用:加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是_______________________________。
(5)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明下列情况下使用玻璃棒的目的;
过滤时:__________________________、蒸发时:________________________
(1)蒸发浓缩(1分)、冷却结晶(1分)
(2)HCl溶液或盐酸(1分)
(3)加入MgCl2溶液,充分搅拌,过滤,用水洗涤沉淀(2分)
(4)MgO的熔点很高,熔融时耗能太大而增加生产成本(2分)
(5)引流(1分),使待滤液沿玻璃棒流入漏斗,防止外溅(1分);搅拌(1分),防止溶液因局部受热温度过高而引起溶液飞溅(1分)。
题目分析:((1)操作②是从溶液中得到MgCl2晶体,故是蒸发浓缩、冷却结晶、过滤。
(2)试剂a将Mg(OH)2转化为MgCl2,故a是盐酸或HCl溶液。
(3)Mg(OH)2沉淀中混有的Ca(OH)2,可以采用加入MgCl2溶液,充分搅拌,过滤,用水洗涤沉淀,除去Ca(OH)2。
(4)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质;而不采用:加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是MgO的熔点很高,熔融时耗能太大而增加生产成。
(5)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒。过滤时用于引流,使待滤液沿玻璃棒流入漏斗,防止外溅;蒸发时用于搅拌,防止溶液因局部受热温度过高而引起溶液飞溅。
