问题
计算题
将6.50g锌投入200mL某浓度的盐酸溶液中,锌和盐酸恰好完全反应。计算:
⑴6.50g锌的物质的量
⑵所用盐酸中HCl的物质的量浓度
⑶反应后生成的H2在标准状况下的体积
答案
(1)0.1mol (2)CHCl="1mol/L" (3)2.24L
题目分析:(1)n(Zn)=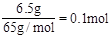 。
。
(2)根据Zn与盐酸反应的方程式可知参加反应的盐酸为0.2mol,所以c(HCl)=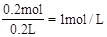 。
。
(3)反应后产生H2为0.1mol,体积为0.1×22.4L/mol=2.24L。
点评:本题非常基础简单,只要根据公式计算就可以。
