(8分)在50 mL a mol/L的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO)=3 mol/L。
(1)求稀释后的溶液c(H+)= 。
(2)若a=9,则生成的气体中NO2的物质的量为 mol。
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入1 mol/L的NaOH恰好被吸收,NaOH溶液的体积为 mL。
(1)1 (2)0.125 (3)150
题目分析:(1)溶液中除了有H+、NO3-还有Cu2+,根据电荷守恒可知c(H+)+2c(Cu2+)= c(NO3-),所以c(H+)= 3-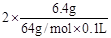 =1mol/L。
=1mol/L。
 (2)设NO2为xmol,NO为ymol,则 x+3y=
(2)设NO2为xmol,NO为ymol,则 x+3y=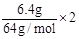 , 解得 x=0.125mol/L
, 解得 x=0.125mol/L
x+y=9×0.05-3×0.1 y=0.025mol/L
所以NO2的物质的量为0.125mol。
(3)根据原子守恒可知,N原子的量等于Na原子的量,所以NaOH为0.15mol,V(NaOH)=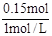 ="0.15L" =150mL。
="0.15L" =150mL。
点评:硝酸与金属反应时,既表现出氧化性,又表现出酸性,根据守恒法计算比较简单。
